 点击排行
点击排行
- 1.重庆市举办药品上市许可持有人药品不良反应直接报告系统培训班
- 2.市药监局举办《医疗器械不良事件监测和再评价管理办法》暨“国家医疗器械不良事件监测系统”培训工作会
- 3.重庆市举办药品不良反应监测哨点医院建设沟通交流会
- 4.2018年重庆市药品不良反应报告和监测情况通报
- 5.周隆海局长调研药品不良反应监测工作
- 6.基于HIS的医院药物警戒系统建立与应用项目采购结果公告
- 7.基于HIS的医院药物警戒系统建立与应用项目采购公告
- 8.关于发布2018年重庆市医疗器械不良事件监测年度报告的公告
- 9.2018-2019年重庆市在校中学生非医疗目的使用精神活性物质情况抽样调查课题圆满结题
- 10.重庆中心积极推进医疗机构药物滥用监测
第一章2020年全市医疗器械不良事件报告概况
一、2020年医疗器械不良事件报告总体概况
2020年全国医疗器械不良事件监测系统收到我市基层单位报告的《可疑医疗器械不良事件报告表》共计10549份(不包含审核未通过的报告)。同时,收到全国涉及我市医疗器械注册人/备案人(生产企业)的报告4355份,注册人提交定期风险评价报告475份。
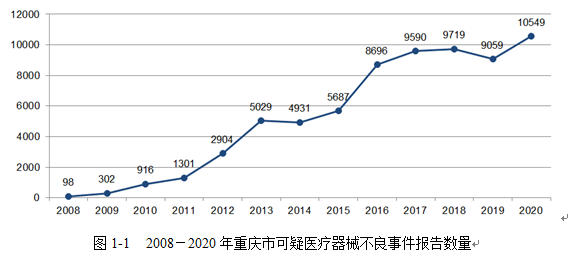
从每百万人口报告数来看,2020年我市每百万人口平均可疑医疗器械不良事件报告数为309例,与去年相比增长了16.60%。
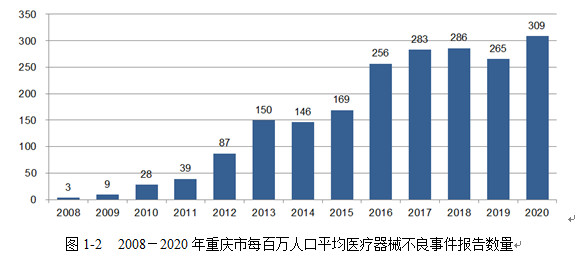
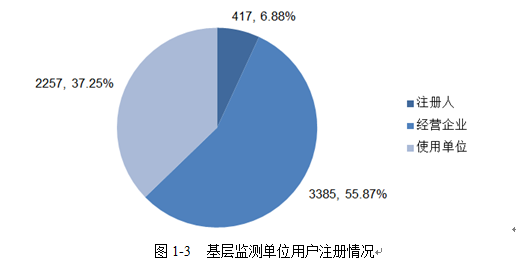
二、基层监测单位注册情况
截至2020年12月31日,国家医疗器械不良事件监测信息系统中共有我市基层监测单位注册用户6059家,其中医疗器械注册人417家,占用户总数的6.88%;经营企业3385家,占用户总数的55.87%;使用单位2257家,占用户总数的37.25%。
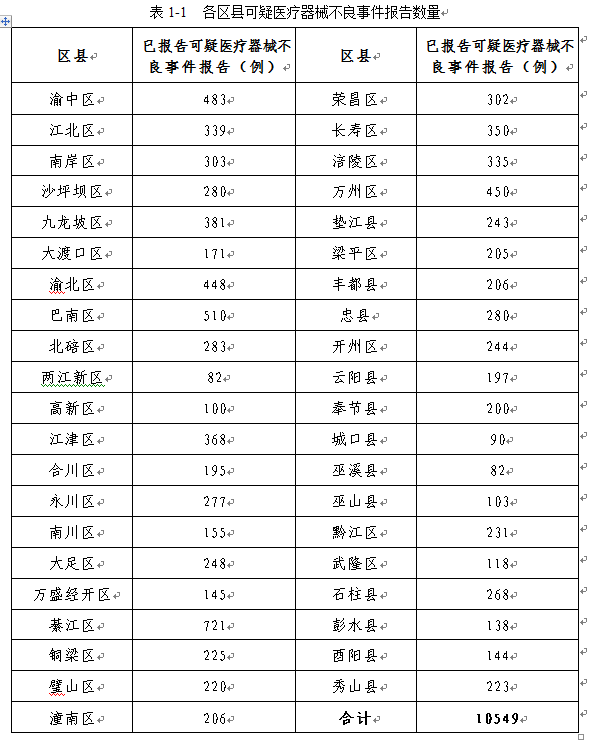
三、各区县可疑医疗器械不良事件报告上报情况
2020年各区县上报的可疑医疗器械不良事件报告数量统计中,排名前五位的分别是綦江区、巴南区、渝中区、万州区、渝北区。各区县之间的报告数量所呈现的差异主要与监测法规落实力度以及医疗资源、人口密度等因素相关。
第二章 2020年全市医疗器械不良事件报告统计分析
一、可疑医疗器械不良事件报告来源情况分析
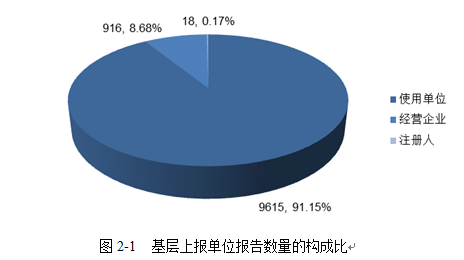
2020年我市上报的可疑医疗器械不良事件报告中,来自医疗器械使用单位的报告共9615份,占总报告数的91.15%;来自经营企业的报告916份,占总报告数的8.68%;来自注册人的报告18份,占总报告数的0.17%。与往年相比,各类基层单位报告数量构成比无明显变化,使用单位依然是报告的主要来源。
二、可疑医疗器械不良事件伤害程度情况分析
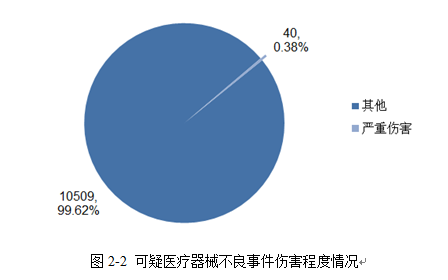
2020年收到的可疑医疗器械不良事件报告中,共有40例是导致或可能导致严重伤害的不良事件,占总报告数的0.38%,无死亡病例报告。严重伤害报告所占比例较去年(0.23%)无明显变化。
三、可疑医疗器械不良事件涉及管理类别情况分析
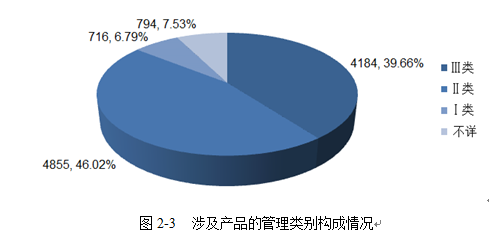
2020年我市上报的可疑医疗器械不良事件报告中,Ⅰ类医疗器械共716例,占总报告数的6.79%,涉及医用绷带、纱布、敷料及医用棉签、物理治疗贴等产品;Ⅱ类医疗器械共4855例,占总报告数的46.02%,涉及理疗贴、物理治疗仪等产品;Ⅲ类医疗器械共4184例,占总报告数的39.66%,涉及一次性使用输液器、一次性使用注射器、角膜接触镜等产品;还有794例报告(7.53%)由于企业注册证未维护、注册证号格式不准确等原因无法识别统计其管理类别。
四、可疑医疗器械不良事件涉及产品分类目录情况分析
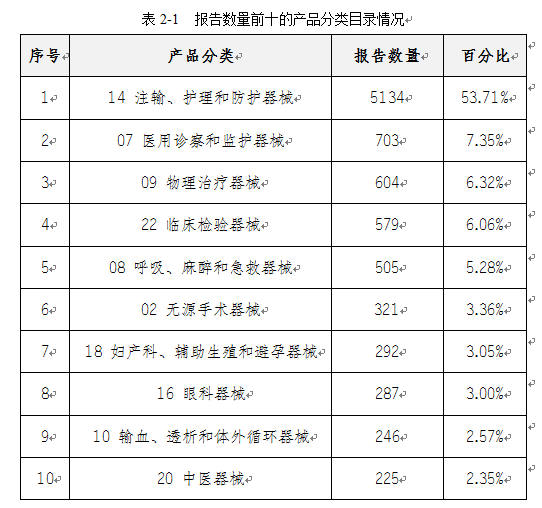
2020年我市上报的医疗器械不良事件报告所涉及的医疗器械分类目录,主要包括注输、护理和防护器械、医用诊察和监护器械、物理治疗器械等。报告数量前十的产品分类情况如表2-1所示。
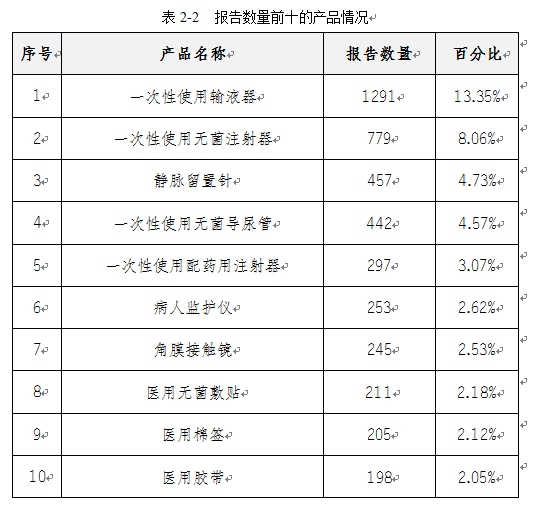
五、可疑医疗器械不良事件涉及产品名称情况分析
2020年我市上报的医疗器械不良事件报告所涉及的具体器械品种,主要集中在一次性使用耗材类产品中,包括一次性使用输液器、注射器、留置针,导尿管等。报告数量前十的产品情况如表2-2所示。
六、可疑医疗器械不良事件涉及产品结构特征情况分析
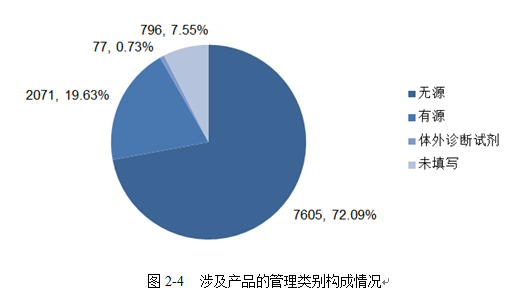
2020年我市上报的医疗器械不良事件报告中,涉及无源医疗器械的报告7605份,占报告总数的72.09%;涉及有源医疗器械的报告2071份,占报告总数的19.63%;涉及体外诊断试剂的报告77份,占报告总数的0.73%;另有796份报告因注册证号信息未维护等原因无法识别其结构特征。
七、可疑医疗器械不良事件涉及使用场所情况分析
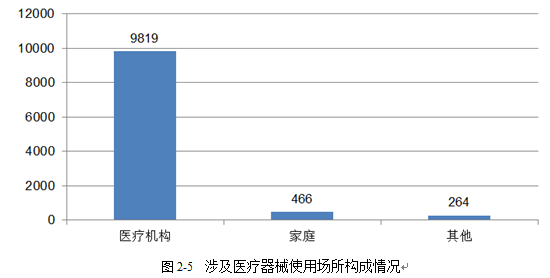
本年度我市上报的可疑医疗器械不良事件报告中,使用场所为医疗机构的报告共9819份,占总报告数的93.08%;使用场所为家庭的报告共466份,占总报告数的4.42%;使用场所为其他的报告数共264份,占总报告数的2.50%。医疗机构是监测报告的主要来源,家庭使用医疗器械所占报告比例依旧较小。
第三章 2020年医疗器械监测评价重点工作小结
一、关注防疫器械风险,保障疫情防控工作
按照国家中心和市局的要求,监测中心在疫情期间切实履行监测工作职责,全力配合开展好疫情防控用械不良事件监测工作。为第一时间发现疫情防控用械的安全风险,与新型冠状病毒感染的肺炎重症定点医疗救治医院建立了联系,设立了有关疫情防控用械质量问题或不良事件的快速报告通道。
密切关注 “国家医疗器械不良事件监测信息系统”涉及应急监测产品目录的不良事件报告,及时调查核实并上报处理相关报告。2020年累计核实处置涉及一次性使用医用口罩、医用外科口罩等防疫用器械报告131例,未发现明显风险信号。监测情况定期向相关监管部门进行了汇报,切实保障了疫情期间防疫器械的使用安全。
二、全面强化创新医疗器械企业主动监测能力
针对创新医疗器械生产企业开展监测工作能力提升专项工作,多次赴我市创新医疗器械生产企业开展现场调研,就创新产品上市后常见风险进行了深入的交流,立足法规对创新医疗器械安全性监测与评价工作提出了具体建议和意见, 提升了企业的主体责任意识,促进企业完善医疗器械不良事件监测工作制度,为创新医疗器械在临床的安全使用提供了有力保障。
2020年11月承办了国家中心在重庆组织召开的创新医疗器械不良事件监测工作讨论会,会议邀请了审评相关专家介绍了创新医疗器械审评技术要点、上市前审评审批与上市后监测工作的结合实践等内容,并由江苏、浙江、山东和广东四个省交流了创新医疗器械不良事件监测与评价工作经验。会议进一步明确了创新医疗器械监测工作的要求,推动了创新医疗器械相关法律法规的贯彻落实,为创新医疗器械不良事件监测工作在全国的开展奠定了坚实的基础。
三、着力拓展医疗机构不良事件报告覆盖面
按照国家药监局要求,结合《国家药监局关于进一步加强药品不良反应监测评价体系和能力建设的意见》文件精神,全面提升我市医疗机构不良事件报告覆盖率。为圆满完成此项工作,针对我市二级及以上医疗机构存在的底数难以摸清、医院等级难以确定、注册和报告情况难以统计等情况,市监测中心协同各区县市场局,对各医疗机构在国家医疗器械不良事件监测信息系统中实际注册报告情况进行逐一核对,指导医疗机构开展注册和报告工作。共审核新注册二级及以上医疗机构账号91个,审核医疗机构新提交报告300余份,全面完成了我市二级及以上医疗机构注册和报告工作。
 渝公网安备 50011202502103号
渝公网安备 50011202502103号